二氧化硫废气治理-钠碱法脱硫
- 钠碱法是采用碳酸钠或氢氧化钠等碱性物质吸收烟气中 SO 2 的方法。与用其他碱性物质吸收SO 2 相比,该法具有如下优点。 (1)与氨法比,它使用固体吸收剂,碱的来源限制小,便于运
- 咨询热线:13262213023
-
产品详情
钠碱法是采用碳酸钠或氢氧化钠等碱性物质吸收烟气中 SO2的方法。与用其他碱性物质吸收SO2相比,该法具有如下优点。
(1)与氨法比,它使用固体吸收剂,碱的来源限制小,便于运输、贮存。而且由于阳离子为非挥发性的,不存在吸收剂在洗涤气体过程中的挥发及产生铵雾问题,因而碱耗小。
(2)与使用钙碱的方法相比,钠碱的溶解度较高,因而吸收系统不存在结垢、堵塞等问题。
(3)与使用钾碱的方法相比,钠碱比钾碱来源丰富且价格要便宜得多。
(4)钠碱吸收剂吸收能力大,吸收剂用量少,可获得较好的处理效果。
但与氨碱及钙碱相比,碱源相对比较紧张,特别是NaOH,来源更困难一些。
由于对吸收液的处理方法不同,所得副产物的不同,钠碱法中也有不同的脱硫方法。具体方法主要有亚硫酸钠法、亚硫酸钠循环法及钠盐﹣酸分解法等。在国内,亚硫酸钠法应用较多,其他方法应用较少或仍在研究探讨之中。

(一)钠碱法的吸收反应
该法采用Na2CO3或NaOH作为起始吸收剂,在与SO2气体的接触过程中,发生如下
的化学反应:
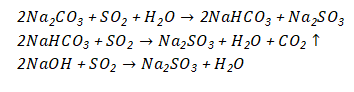
吸收开始时,主要按照上面三个反应生成Na2SO3,Na2SO3具有吸收SO2的能力,能继续从气体中吸收SO2:
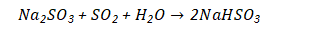
NaHSO3不再具有吸收SO2的能力,因此式是主要的吸收反应,而实际的吸收剂为Na2SO3。
吸收过程的主要副反应为氧化反应:
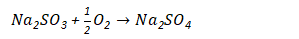
从以上反应可知,循环吸收液中的主要成分为Na2SO3、NaHSO3和少量的Na2SO4。
(二)吸收液的 pH 值
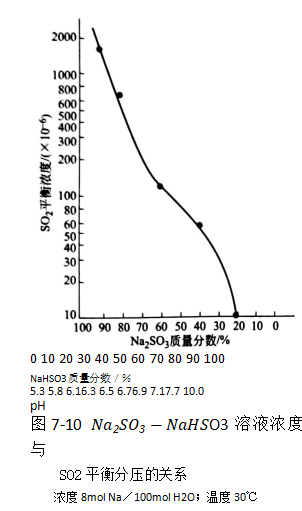
在用钠碱吸收SO2的过程中,吸收液中亚硫酸钠、亚硫酸氢钠的浓度关系与吸收液的pH值有单值的对应关系,这种对应关系表示在图7-9中。从图中可以看出,随吸收液中亚硫酸氢钠含量的升高,溶液的ph值下降。
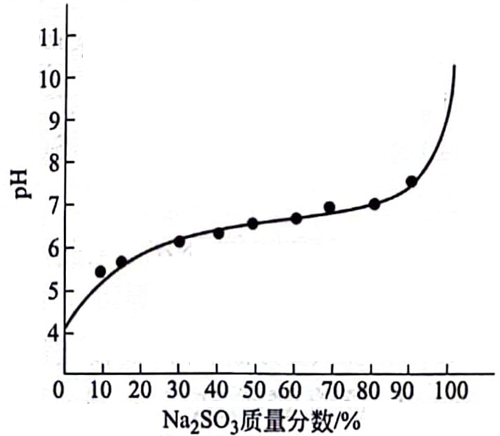
由于NaHSO。对SO2不具有吸收能力,因此,吸收液的pH值愈小,吸收液吸收SO2的能力越差。以用NaOH处理烟气为例,由于烟气中含有大量的CO2,用所制备的NaOH溶液洗涤气体时,首先发生的CO2与NaOH的反应导致了吸收液pH值的降低。当pH值降至7.6以下时,方发生吸收SO2的反应。当吸收液中的Na2SO3全部转变为NaHSO3时,溶液的pH值为4.4,此时将不可能继续与SO2起化学反应。此后的吸收液若继续与SO2接触,pH值可继续下降至3.7,但此时pH值的降低,仅仅是由于SO2在溶液中进行物理溶解所致。因此,吸收液有效吸收SO2的pH 值范围为4.4~7.6。在实际引出吸收液进行处理时,吸收液的pH值应控制在此范围内的一个适宜值上。

(三)SO2的分压
吸收液吸收SO2的能力取决于吸收液面上SO2的平衡分压,液面上 SO2平衡分压值愈小,吸收液对SO2的吸收能力愈大。
Na2SO3-NaHSO3液面上SO2的分压值,可用以下公式计算:
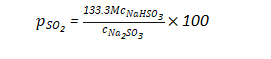
式中,PSO2为SO2分压,Pa;Cna2HSO,为溶液中NaHSO3物质的量浓度;CNa2SO2为溶液中Na2SO3物质的量浓度;M为根据温度决定的系数,可由下式求出:
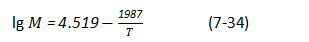
式中,T为绝对温度,K。
从式可知,吸收液面上的So2分压与溶液中酸式盐浓度的平方成正比,而与正盐浓度成反比。由此可以得出:
(1)正盐与酸式盐之比越大,液面上的so2分压就越低,这种溶液在处理较低浓度的so2气体时,仍可获得较好的吸收率;
(2)在正盐与酸式盐浓度比不变的条件下,将溶液稀释,so2的分压就会降低,为了较充分地从气体中吸收SO2,就必须使用稀的吸收溶液;
(3)降低吸收液温度,可降低so2平衡分压,可提高吸收效率。
na2so3-NaHso3溶液浓度与SO2平衡分压关系见图7-10.